Die isoelektrische Fokussierung (IEF) als Trennmechanismus wurde bereits im Rahmen der klassischen Elektrophorese unter Verwendung von Gelplatten (Flachbett-IEF) häufig angewandt, um zwitterionische und amphotere Analyten zu bestimmen.
Mit der Verwendung von Kapillaren als Trennsäule und dem Bau automatisierter Kapillarelektrophorese-Geräte wurde auch die IEF reformiert. Durch effizientere Wärmeabfuhr in Kapillaren im Vergleich zu den klassischen Gelen konnten nun mit der cIEF („Kapillar-Isoelektrische Fokussierung“) kürzere Trennzeiten und bessere Auflösungen erreicht werden. Gleichzeitig bringt die mögliche on-line Detektion eine wesentliche Arbeitserleichterung und Quantifizierbarkeit mit sich. Eine Automatisierung ist ohne weiteres möglich.
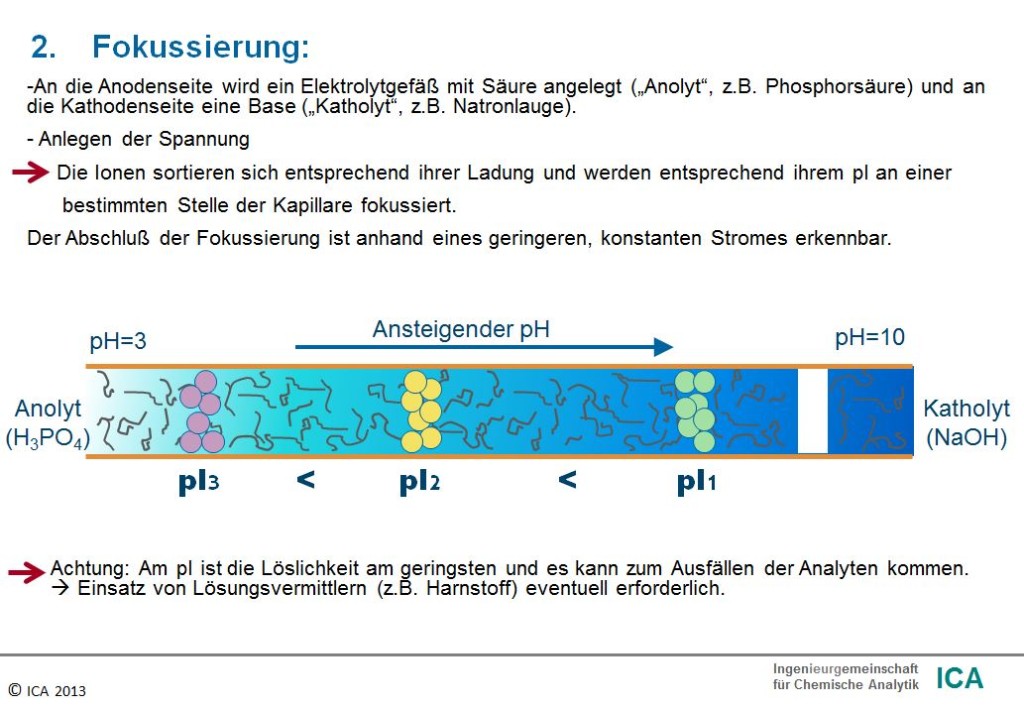
Die Trennung erfolgt aufgrund unterschiedlicher isoelektrischer Punkte (pI-Werte) der Analyten. Aus dem pI-Wert geht hervor, bei welchem pH-Wert die jeweilige Substanz elektrisch neutral ist. Wenn dieser pH-Wert erreicht ist, kann die Substanz nicht mehr im elektrischen Feld wandern.
Diese Tatsache macht man sich mittels eines über die gesamte Kapillarlänge verlaufenden pH-Gradienten zu Nutze. Der pH-Gradient wird erzeugt, indem die gesamte Kapillare zunächst mit einer Ampholytlösung gefüllt wird, die außerdem die Probelösung, ein stabilisierendes Medium, Puffersubstanzen und eventuell Harnstoff enthält.
An die Anodenseite der Kapillare (positiver Pol) wird anschließend ein niedriger pH-Wert (z.B. Phosphorsäure) vorgelegt, während an der Kathodenseite (negativer Pol) eine Lösung mit hohem pH-Wert (z.B. verdünnte NaOH) eingefüllt wird.
Nach Einschalten der Spannung sortieren sich die in die Kapillare eingefüllten Ampholyte entsprechend ihrem pI-Wert, so dass in der Kapillare ein pH-Gradient aufgebaut wird. In diesem pH-Gradient kann eine eingebrachte Probelösung entsprechend ihrer pI-Werte aufgetrennt werden.
Die Fokussierung an eine bestimmte Stelle in der Kapillare erfolgt automatisch: Verlässt ein Analyt die eigene Zone (z.B. durch Diffusion), so gelangt es in einen Bereich mit anderem pH-Wert und erlangt dadurch wieder eine elektrische Ladung, die eine Wanderung zurück in die eigene Zone (die dem pI entspricht) bewirkt. Die Peakverbreiterung durch Diffusion wird somit durch den fokussierend wirkenden pH-Gradient unterdrückt, so dass eine hohe Trenneffizienz erreicht wird.
Der Fortschritt der Trennung kann indirekt über die Stromkurve verfolgt werden. Der anfangs hohe Strom nimmt kontinuierlich ab und bleibt dann annähernd konstant.
Sobald die Fokussierung der Ampholyte und Probenbestandteile abgeschlossen ist, kann ein geringer, konstanter Strom fließen und die Trennung ist abgeschlossen. Die Kontinuität des pH-Gradienten und damit die Trenneffizienz der IEF hängt von der Zusammensetzung der Ampholytlösung ab. Die einzelnen Ampholyte sind zwitterionische Substanzen und müssen möglichst den gewünschten pI-Bereich abdecken. Je feiner die pI-Abstufung der Ampholyte ist, umso besser wird die mögliche Auflösung sein.
Nach der Auftrennung der Probe muss der gesamte Kapillarinhalt „mobilisiert“ werden, um die Detektion zu ermöglichen. In der cIEF gibt es prinzipiell drei Möglichkeiten, die Mobilisierung durchzuführen:
1. Anlegen eines externen Druckes.
Dieses Prinzip wird mittlerweile am häufigsten angewandt. Nach Abschluss der Fokussierung (erkennbar am annähernd konstanten Strom) wird parallel zur Trennspannung ein Druck angelegt und der gesamte Kapillarinhalt so am Detektor vorbeigeführt.
Der Nachteil besteht darin, dass Analyten mit sehr hohem pI eventuell innerhalb der Kapillarstrecke von Detektion und Kathode fokussiert sind. Diese werden dann ohne den Detektor passiert zu haben aus der Kapillare herausgespült. Um dies zu umgehen, kann eine Ampholytlösung, die einen höheren pH-Bereich ausfüllt, ausgewählt werden. Häufig wird TEMED als Spacer der Ampholytlösung zugesetzt. Alternativ könnte der kritische Kapillarabschnitt mit der Kathodenlösung (verdünnte NaOH) befüllt werden, um so den pH-Gradienten lokal vorzuverlegen. Beide „Tricks“ sind prinzipiell geeignet, die interessierenden Probenbestandteile eventuell noch vor der Detektorzone zu fokussieren. Bei der Verwendung von beschichteten Kapillaren muss jedoch berücksichtigt werden, dass die Beschichtung von starken Laugen oder Säuren zerstört werden kann.
2. Verwendung des EOF
Wenn unbeschichtete fused silica-Kapillaren verwendet werden, wird der gesamte Kapillarinhalt durch den EOF in Richtung der Kathode und somit am Detektor vorbeibewegt. Der Nachteil besteht darin, dass der EOF bereits mit Beginn der Trennung kleine Mengen des Kapillarinhalts aus der Kapillare herausspült und somit ein Verlust an Probe und Ampholyt auftreten kann.
3. Chemische Mobilisierung
Zur chemischen Mobilisierung wird der detektorseitigen Lösung ein Salz zugesetzt. Beispielsweise können der NaOH-Lösung an der Kathodenseite Chlorid-Ionen oder auf Anodenseite Natrium-Ionen zugemischt werden. Dadurch kann der pH-Gradient nicht mehr aufrechterhalten werden und die einzelnen Analyten und Ampholyten erhalten eine Ladung, die nun wieder die eigene Fortbewegung im elektrischen Feld gestattet.
Dr. Jana Boden, ICA, 2013.