Die elektrokinetische Chromatographie (EKC) ist eine Kombination von Elektrophorese und Chromatographie. Die Einführung einer chromatographischen Phase dient zur Erhöhung der Selektivität. Durch die Anwendung eines elektrischen Feldes zum Transport der Flüssigkeit in der Kapillare können auch hier hohe Trennleistungen erreicht werden. Bei den EKC-Verfahren werden dem Elektrolyten Substanzen zugesetzt, die eine eigene Mobilität im elektrischen Feld besitzen. Man bezeichnet diese Zusätze als pseudostationäre Phasen (PSP). Aufgrund ihrer Wechselwirkung mit den Analyten tritt eine Veränderung der Selektivität und damit eine Trennung der Analyten auf. Als Modellsubstanzen für die Untersuchung von Systemen mit pseudostationären Phasen kommen hydrophobe Moleküle wie polyzyklische aromatische Kohlenwasserstoffe (PAK), Naphthalinderivate oder Amine in Frage. Ihre Trennung stellt aufgund ihrer strukturellen Ähnlichkeit eine Herausforderung dar. Aufgrund der Bildung homologer Reihen bieten sie sich für mechanistische Untersuchungen an.
Setzt man die aus der Chromatographie bekannten Phasen für die EKC ein, so wird eine Vorhersage der Retentionsreihenfolge möglich, da die Trennung neutraler Spezies den Regeln der Flüssigchromatographie folgt.
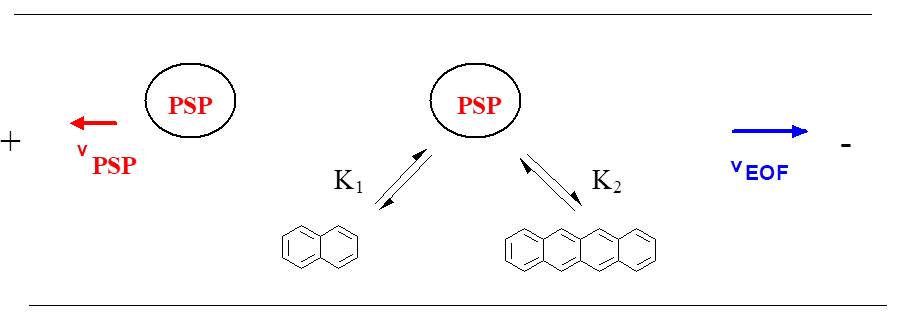
Abbildung 1: Trennprinzip in der EKC
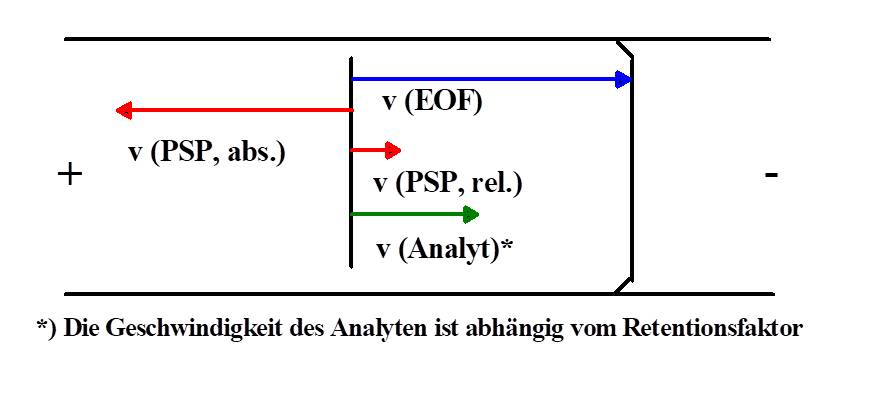
Durch den Zusatz der PSP ergibt sich eine Überlagerung verschiedener Transportmechanismen in der Kapillare, siehe Abbildung 1. Der erste Mechanismus kommt durch den EOF zustande, er befördert das gesamte Flüssigkeitsvolumen in der Kapillare. Ungeladene Moleküle bewegen sich deshalb mit EOF-Geschwindigkeit in Richtung Kathode. Der zweite Mechanismus resultiert aus der Bewegung der PSP. In der EKC findet eine Wechselwirkung zwischen dem Analyten und der PSP statt, die zu einer Veränderung der Analytgeschwindigkeit führt. Um eine gute Trennung der Analyten zu erreichen, sollte die Geschwindigkeit der PSP möglichst hoch und in Gegenrichtung zum EOF orientiert sein. Dabei muss aber der Transport der Analyten zum Detektionsfenster noch gewährleistet sein. Die in der EKC auftretenden Relativgeschwindigkeiten ergeben sich durch vektorielle Addition der Absolutgeschwindigkeiten, dies ist schematisch in Abbildung 2 dargestellt.
Abbildung 2: Geschwindigkeitsvektoren in der EKC
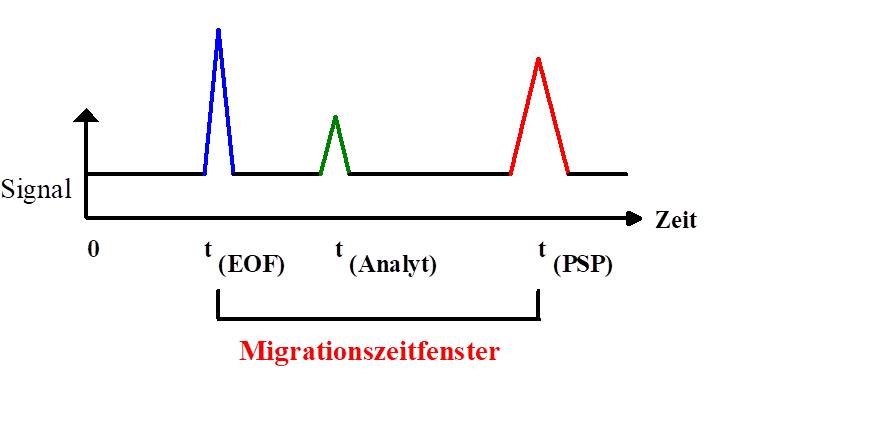
Die Analytgeschwindigkeiten ergeben sich durch unterschiedliche Wechselwirkungen mit der PSP. Sie sind abhängig vom Retentionsfaktor der Substanz. Für ungeladene Substanzen ergibt sich das in Abbildung 3 beschriebene schematische Chromatogramm.
Abbildung 3: Migrationszeitfenster in der EKC
Bei kathodischer Migrationsrichtung des EOF gelangen zunächst alle Substanzen, die nur durch den EOF transportiert werden, also ungeladen sind und keine Wechselwirkung mit der PSP eingehen, zum Detektor. Solche Spezies bezeichnet man als Neutralmarker; sie haben einen Retentionsfaktor von Null. Danach folgen bei einer anionischen (anionisch migrierenden) PSP die ungeladenen Analyten in der Reihenfolge mit zunehmender Stärke der Wechselwirkungen, d.h. mit steigendem Retentionsfaktor. Das letzte Signal wird von Substanzen hervorgerufen, die während der gesamten Analysenzeit in Wechselwirkung mit der PSP stehen, also einen unendlich hohen Retentionsfaktor besitzten. Die Zeit zwischen der Migrationszeit von EOF und der PSP nennt man Migrationszeitfenster.
(aus Beate Göttlicher, Dissertation TH Darmstadt, 1997, S. 10-13)
Die mizellare elektrokinetische Chromatographie (MEKC)
Im Jahre 1984 begründete Terabe die mizellare EKC (MEKC) [Terabe, S., Ando, T., Ishikawa, K., Otsuka, K. und Tsuchiya, A. (1984), Anal.Chem. 56, 111], indem er unter Anwendung einer gewöhnlichen Kapillarelektrophorese-Anordnung Elektrolytlösungen mit dem anionischen Detergenz Natriumdodezylsulfat (SDS) oberhalb der kritischen Mizellbildungskonzentration (CMC) als Trennphase einsetzte. Aufgrund unterschiedlicher Affinitäten zu den Mizellen trennte er verschiedene Phenolderivate als Stellvertreter für ungeladene Substanzen [Terabe, S., Ando, T. und Otsuka, K. (1985), Anal. Chem. 57, 834].
(aus Beate Göttlicher, Dissertation TH Darmstadt, 1997, S. 20)
Mizellare elektrokinetische Chromatographie mit Cyclodextrinen
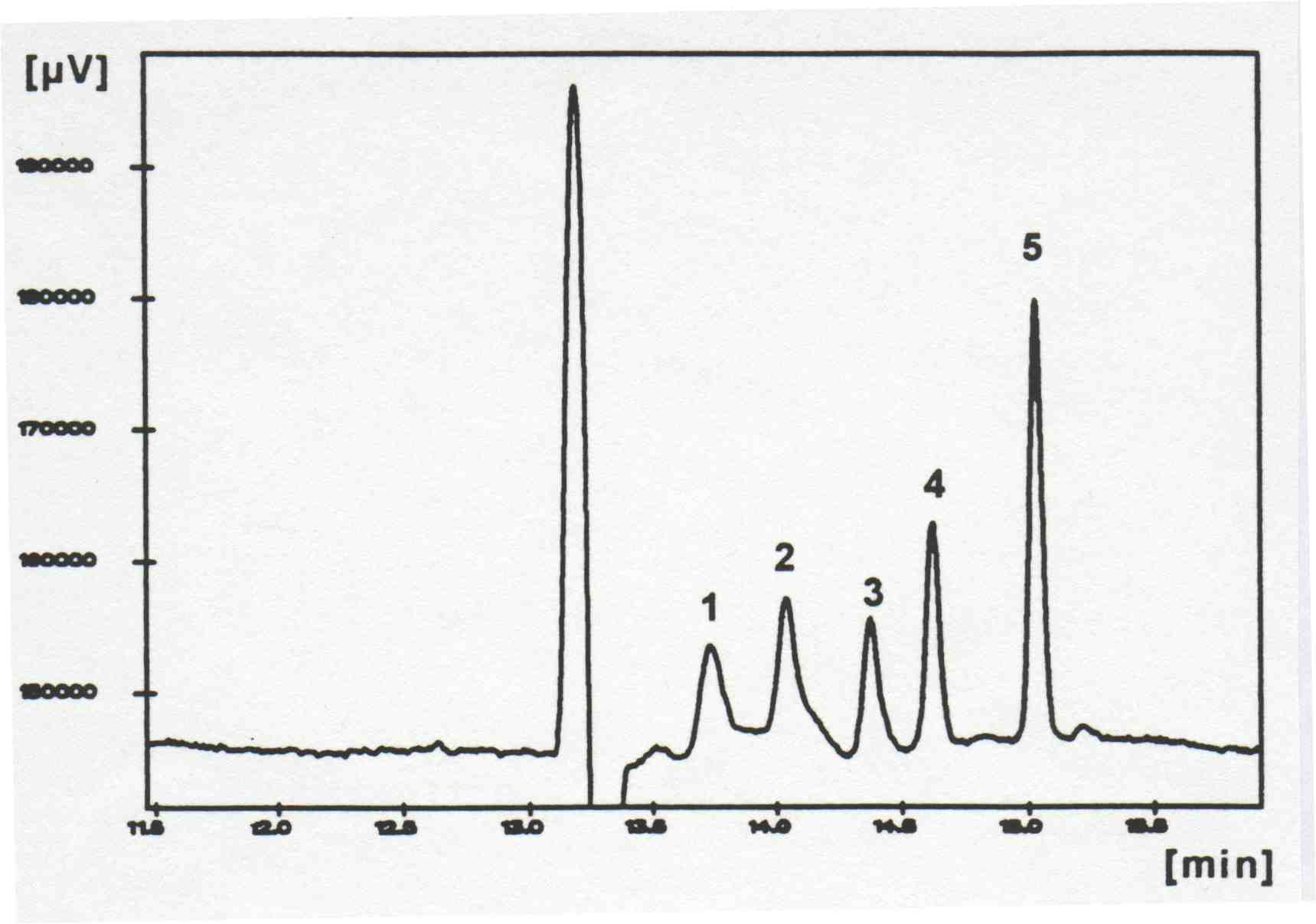
Die Trennung von stark hydrophoben Substanzen, wie z.B. die PAK mit der MEKC erwies sich jedoch als schwierig, da diese Analyten in wäßrigen Elektrolytlösungen praktisch vollständig in den Mizellen inkorporiert sind und somit bei der Migrationszeit der Mizellen koeluieren. Im allgemeinen werden organische Lösungsmittel zur Erhöhung der Affinität zum Elektrolyten und damit zur Veränderung dieses Gleichgewichtes zugesetzt. Aufgrund der mangelnden Stabilität der Mizellen in organisch/wäßrigen Medien ist dies jedoch nur bis ca. 40 Vol.% möglich [Dorsey, J.G., DeEchegaray, M.T. und Landy, J.S. (1983), Anal. Chem., 55, 924]. Bessere Ergebnisse ließen sich durch Zusatz von Cyclodextrinen (CD) zur Mizelllösung erzielen (CD-MEKC) [Terabe, S., Miyashita, Y., Shibata, O., Barnhart, E.R., Alexander, L.R., Patterson, D.J., Karger, B.L., Hosoya, K. und Tanaka, N. (1990), J. Chromatogr. 516, 23]. Hier wird die Löslichkeit der Analyten durch die Bildung von Inklusionskomplexen erhöht [Yik, Y.F., Ong, C.P., Khoo, S.B., Lee, H.K. und Li, S.F.Y. (1992), J. Chromatogr. 589, 333]. Diese Methode ist jedoch auf Analyten beschränkt, die in den Innenraum des jeweiligen Cycldextrins passen. Abbildung 4 zeigt die Trennung der kleineren PAK mit ß-CD. Eine gute Übereinstimmung der Größe des Innenraums des CDs mit der Größe des Analyten führt zu einem stabilen Inklusionskomplex und damit zu einer guten Abtrennung vom EOF (Anthazen passt besser als Pyren).
Abbildung 4: Trennung von PAK mit der CD-EKC
Identifizierung: 1) Pyren, 2) Fluoranthen, 3) Naphthalin, 4) Phenanthren, 5) Anthracen
(aus K.-Y. Han, Dissertation TH Darmstadt, 1995)
Besonderes Interesse fällt den CD aufgrund ihrer Chiralität zu. Sie werden deshalb häufig zur Enantiomerentrennung eingesetzt [Snopek, J., Jelinek, I., Smolkova-Keulemansova, E. (1988), J. Chromatogr. 452, 571].
(aus Beate Göttlicher, Dissertation TH Darmstadt, 1997, S. 23-24)
Möglichkeiten zur Optimierung von EKC-Trennungen:
Für den Anwender steht eine breite Palette an pseudostationären Phasen zur Verfügung. Die EKC ist, wie die anderen Kapillarverfahren auch, eine robuste Methode.
Auswahl der PSP:
• Anionische Mizellbildner, wie Natriumdodecylsulfat (SDS)
• Kationische Mizellbildner, wie Cetyltrimethylammoniumbromid (CTAB) (Vorsicht hier erfolgt zusätzlich eine Belegung der Kapillarwand mit dem Modifier und damit eine Modifizierung, evtl. sogar Umkehr des EOF)
• Gallensalze
• Zwitterionische Detergenzien, wie N-Dodecyl-N,N-dimethyl-3-ammonio-1-propansulfonat (DAPS)
• Tween 20 (bildet auch gemischte Mizellen mit SDS)
• Cyclodextrine (α, β und ɣ mit vielen geladenen und ungeladenen funktionellen Gruppen, geeignet für Trennung von Enantiomeren)
• lineare Oligo- und Polysaccharide (Maltodextrin und Dextran), geeignet für Trennung von Enantiomeren
• vernetzte Polysaccharide (Glycogen), geeignet für Trennung von Enantiomeren
Dr. Beate Göttlicher, ICA, 2018.